Kevésbé ismert, hogy az írott nyelv ékezeteinek analógjai léteznek az élőlények genetikai információját rejtő nukleinsavakban is. Az élet kódjának "ékezeteit", vagyis az örökítőanyagban tárolt minden, a nukleotid sorrenden felüli információt epigenetikai módosításoknak nevezik. Ezek a módosítások létfontosságúak minden kicsit is bonyolultabb többsejtű élőlény számára is: nélkülük az embereknek sem lehetnének különböző típusú sejtjeik úgy, hogy genetikai kódjuk egyébként azonos - emlékeztet a Magyar Tudományos Akadémia (MTA) közleménye.
Mint írták, az elmúlt évtizedekben leginkább a genetikai információ hosszú távú tárolását végző DNS epigenetikai módosításai álltak a figyelem és a kutatások középpontjában, de az utóbbi években egyre több eredmény bizonyította, hogy másik kulcsfontosságú nukleinsavat, az RNS-t érintő epitranszkriptomikus módosulatoknak is fontos szerepük van a sejtek megfelelő működésében. Az MTA-SE Lendület Nephrogenetikai Kutatócsoport vezetésével a Semmelweis Egyetem (SE), az ELTE, valamint a University College London kutatói a napokban megjelent tanulmányukban azt mutatták ki, hogy milyen súlyos következményekkel járhat, ha a sejtek egyik "RNS-ékezetét" készítő enzim meghibásodik a szervezetben.
Az Egyesült Államok Tudományos Akadémiájának hivatalos folyóirata, a Proceedings of the National Academy of Sciences lapjain publikált kutatás kiindulási pontját a Semmelweis Egyetem I. Számú Gyermekgyógyászati Klinikáján Szabó Attila professzor által gondozott, ismeretlen eredetű betegségben szenvedő család adta. A Tory Kálmán (SE I. Sz. Gyermekgyógyászati Klinika) által vezetett MTA-SE Lendület Nephrogenetikai Kutatócsoport az elsősorban a fiúkat érintő vese-, szem-, fül- és bélérintettséggel járó kórkép eredetének nyomába eredt. Előbb a párizsi Imagine Intézettel együttműködésben azonosították a felelős régiót az X-kromoszómán, majd a Kölni Egyetemen szekvenálva a régiót megtalálták a kóroki variánst a diszkerin enzimet kódoló DKC1 génben. A diszkerin az egyike azoknak az enzimeknek, amelyek az RNS-molekulák "ékezeteiért" felelnek.
A Lendület-kutatócsoport rámutatott, hogy a kóros mutáció három generációval korábban, a betegséggel együtt alakult ki a családban.
A DKC1 gén szerepe váratlan volt, mert variánsait korábban egy teljesen más betegségben azonosították. A génhez társuló új betegség szokatlan eredetére a fehérjeszerkezeti kutatások mutattak rá.
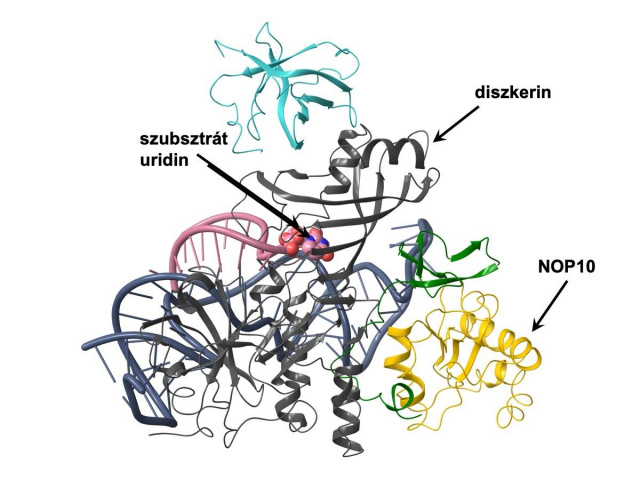
A fehérjekomplex szerkezete, szürkével a diszkerin, sárgával a NOP10
MTA-SE Lendület Nephrogenetikai Kutatócsoport
A Karancsiné Menyhárd Dóra (MTA-ELTE Fehérjemodellező Kutatócsoport) által végzett szerkezeti modellezés alapján az új DKC1-mutáció hatására károsodik a diszkerin kulcsfontosságú katalitikus régiója és megváltozik a diszkerin kapcsolata egyik partnerével, a NOP10 fehérjével. E számításokat kísérletesen igazolta Balogh Eszter (MTA-SE Lendület Nephrogenetikai Kutatócsoport) és Schay Gusztáv (SE Biofizikai és Sugárbiológiai Intézet). A végső bizonyítékot arra, hogy az újonnan leírt betegséget az enzim károsodása okozza, egy állatmodell szolgáltatta. Varga Máté (ELTE TTK Genetikai Tanszék) csoportja több olyan zebrahalvonalat hozott létre a CRISPR/Cas9 genomszerkesztő rendszer használatával, amely az állatok saját diszkerin enzimjét kódoló génben hordozott mutációkat. A mutáns állatok nagyon hasonló szervi érintettséget mutattak, mint az emberi betegek és vizsgálatukkal ki lehetett mutatni, hogy a betegség számos tünete mögött a sejtosztódás zavara áll.
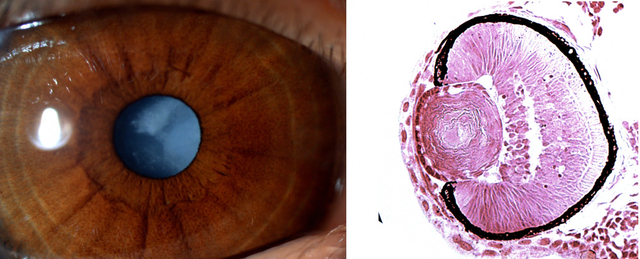
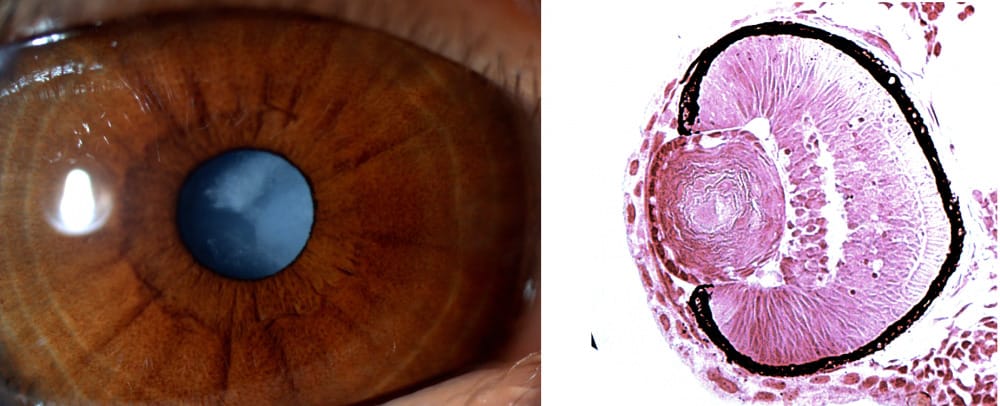
Bal oldalon az egyik beteg szeme, melyen jól megfigyelhető a szürkehályog, jobbra pedig az egyik mutáns zebrahallárva szemének metszete – itt jól látszik, hogy a szemlencse fibrózus szerkezetű (ami szintén a hályog jele)
MTA-SE Lendület Nephrogenetikai Kutatócsoport
A több mint egy évtizeden át tartó munka tartogatott még egy meglepetést: egy londoni kutatócsoport a NOP10 fehérjében is azonosított egy ugyanezen tünetegyüttest okozó variánst, melynek a diszkerin-NOP10 interakcióra gyakorolt hatása megegyezik a diszkerinben talált mutációéval. A közös közlemény így végül angol, francia, kanadai és német kutatókkal való kollaboráció eredménye lett. A kutatók ezzel azonosítottak egy új betegségért felelős kórfolyamatot, valamint a diszkerinmediált pszeudouridiláció szerepét a különböző szervek működésében.
A Lendület program által finanszírozott kutatás példája annak, hogy klinikai megfigyelések hogyan vezethetnek alapkutatásban is fontos folyamatok megismeréséhez, egy betegség okának és mechanizmusának megértéséhez - áll az MTA közleményében.
Ha máskor is tudni szeretne hasonló dolgokról, lájkolja a HVG Tech rovatának Facebook-oldalát.